Новый генотип вируса мешотчатого расплода у пчел APIS MELLIFERA
 Мешотчатый расплод - вирусная болезнь пчелиных личинок. Они погибают, когда прядут свои коконы в запечатанных ячейках перед окукливанием. Погибшие личинки дряблы и водянисты, под кутикулой у них скапливается мутная жидкость, придающая им вид мешочка - отсюда и название. При хроническом течении болезни из-за гибели части расплода (личинок) семья пчел становится менее продуктивной, при обострении семья может погибнуть.
Мешотчатый расплод - вирусная болезнь пчелиных личинок. Они погибают, когда прядут свои коконы в запечатанных ячейках перед окукливанием. Погибшие личинки дряблы и водянисты, под кутикулой у них скапливается мутная жидкость, придающая им вид мешочка - отсюда и название. При хроническом течении болезни из-за гибели части расплода (личинок) семья пчел становится менее продуктивной, при обострении семья может погибнуть.
Болезнь у европейской медоносной пчелы Apis mellifera впервые описал G. F. White в 1913 г. и установил ее вирусную этиологию в 1917 г. [17], однако возбудитель оставался неизученным до 1964 г. Вирус мешотчатого расплода (BMP) был первым вирусом, выделенным от насекомых. Английские исследователи L. Bailey и соавт. [3], изучавшие свойства BMP, показали, что штаммы, выделенные в то время от Apis mellifera в Англии и других странах, серологически не отличались.
Штамм вируса с серологическими отличиями был выделен L. Bailey и соавт. [4] в 1982 г. от погибших личинок азиатской пчелы Apis сегапа из Таиланда и назван тайским ВМР. Позднее тайский ВМР был обнаружен в семьях Apis сегапа в Индии и Непале, где вызывал массовую гибель пчелиных семей [9].
В лабораторных условиях L. Bailey удалось заразить куколок европейской пчелы тайским ВМР. Однако в естественных условиях у каждого вида пчел выявляли только "свой" вирус [10]. Ареалы пчел Apis mellifera и Apis сегапа на протяжении многих тысяч лет не совпадали. В значительных масштабах завоз европейских пчел в ареал азиатских произошел в прошлом веке. Пчел этих двух видов местные пчеловоды часто содержали на одних и тех же пасеках.
По современной классификации, ВМР (английское название - sacbrood virus, SBV) относится к порядку Picornavirales семейству Iflaviridae роду Iflavirus. К этому же роду относится ряд вирусов пчел, среди которых вирус деформации крыльев (ВДК, английское название - deformed wing virus, DWV). Оба вируса представляют собой сферические вирионы в диаметре 30 нм, имеют незначительные морфологические отличия и сходную организацию генома, похожую на таковую пикорнавирусов. Их геном представлен линейной одноцепочечной молекулой РНК (+цепь) длиной около 8900 нуклеотидных оснований с одной открытой рамкой считывания. К 5'-концу геномной РНК ковалентно присоединен белок Vpg, за которым следует протяженная нетранслируемая область (НТО), на З'-конце также располагается НТО, заканчивающаяся цепочкой по-лиаденинов (ро1у(А)-последовательность) [8, 13]. Геномная РНК одновременно служит и матричной РНК для полипротеинового предшественника, из которого в результате протеолиза образуются зрелые вирусные белки. В 5'-проксимальной части генома находятся гены структурных белков капсида в очередности 5'-VР2-VP4-VP1-VP3-3' [13], а в З'-проксимальной части
- гены неструктурных белков (вирусных ферментов хеликазы, протеазы и полимеразы).
Полноразмерная нуклеотидная последовательность геномной РНК определена для пяти штаммов BMP, выделенных от A. mellifera в Великобритании (AF0929241) и А. сеrаnа в Китае (AF469603); (НМ237361) и Южной Корее (HQ322114); (НВ342178
- происхождение неизвестно). Исследование отдельных фрагментов генома изолятов BMP разного географического происхождения [7, 9, 10] позволило выделить, по крайней мере, 3 генетические группы вирусов: азиатскую2, европейскую и южноафриканскую. Азиатский генотип характерен для пчел
'Идентификационный номер последовательности в GenBank.
2 Термин заимствован из работы [7] вместо использованного ранее "дальневосточного генотипа" [9].
А. сеrаnа, распространенных в Китае, Индии, Непале, Японии и других странах Юго-Восточной Азии, к нему же относится вирус, идентифицированный ранее L. Bailey как тайский BMP. Этот вирус наносит серьезный урон азиатским пчелам А. cerana.
Европейский генотип BMP характерен для пчел A. mellifera и встречается у этого вида пчел как в европейских странах, так и в Азии (Непал, Япония). Таким образом, распространение этих двух генотипов, скорее всего, связано с адаптацией к определенному виду пчел. Европейская пчела A. mellifera, видимо, более устойчива к азиатскому генотипу ВМР [9, 10]. Южноафриканский генотип BMP установлен пока только в одном образце из Южной Африки и требует дополнительного исследования [9].
Изучение мешотчатого расплода отечественными исследователями проводится с 30-х годов прошлого века [1]. Установлено, что штаммы BMP, выделенные на территории СССР, имели серологические отличия [2], однако на молекулярно-генетическом уровне исследований до сих пор не было. Настоящая работа посвящена изучению изолятов BMP, выделенных от пчел A. mellifera в разные годы в европейской части России. Методом секвенирования нами были обнаружены, как минимум, два генотипа ВМР: один из них принадлежит европейской группе, второй образует самостоятельную ранее не описанную группу, занимающую промежуточное положение между азиатским и южноафриканским генотипами.
Материалы и методы
Для исследований использовали патологический материал (погибшие личинки и куколки пчел), в котором ранее с помощью реакции иммунодиффузии (РИД) по Ouchterlony (1948) был установлен BMP или ВДК (табл. 1).
Материал собран в разные годы на пасеках Московской, Калужской, Оренбургской обл., Краснодарского края (Кисловодск) и Республики Адыгея (Майкоп). Использовали также лабораторный материал, полученный в результате пассажей (заражение методом микроинъекции куколок пчел и трутней) штамма BMP № 6, выделенного от погибших личинок пчел из Калужской обл. Материал хранился в замороженном или лио-филизированном виде. Отобранные образцы повторно исследовали методом РИД, а также методом полимеразной цепной реакции (ПЦР). Материалом для исследования служили как отдельные особи, так и гомогенат, приготовленный из нескольких особей. В качестве контроля были взяты здоровые личинки и куколки.
РИД проводили в 1% агаре Дифко, приготовленном на фосфатном буферном растворе. В качестве антигена использовали гомогенат из погибших куколок или личинок, либо водные экстракты или экстракты с применением эфира. Реакцию ставили с гипериммунными сыворотками № 6 (1) и № 58, полученными в 1986 г (хранились в лиофилизированном виде).
Сыворотка № 6 (1) получена иммунизацией кролика полевым штаммом BMP № 6 из Калужской обл. Сыворотка № 58 получена иммунизацией кролика неидентифицированными ви-рионами 30 нм в диаметре, выделенными от погибших пчел с деформированными крыльями из Таджикистана.
Кроликов иммунизировали вирионами, сконцентрированными и очищенными дифференциальным центрифугированием. Наличие вирионов в материале для иммунизации контролировали с помощью электронного микроскопа. Вирионы в смеси с адъювантом Фрейнда вводили внутримышечно и в подушечки задних лапок, затем повторно через 21 день без адъюванта внутривенно дважды с интервалом в 7 дней. На 8-е сутки после последней инъекции отбирали кровь для получения сыворотки.
Таблица 1 характеристика исследуемого материала от пчел
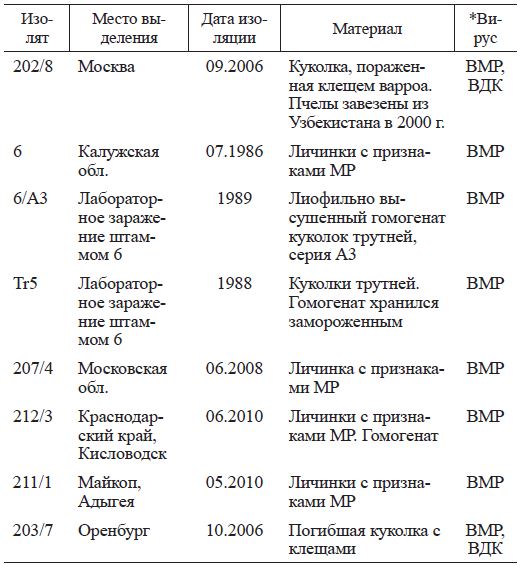
Примечание. *Лабораторное подтверждение в РИД или ПЦР. МР - мешотчатый расплод.
Лиофильно высушенные образцы сывороток были отправлены в Великобританию (Rothamsted Experimental Station, Harpenden, Hertfordshire, UK), где их тестировала доктор Brenda V. Ball методом РИД с разными вирусами пчел (личное сообщение 1988 г.). В любых разведениях обе сыворотки не реагировали на вирус медленного паралича, вирус черных маточников, вирус облачного крыла, вирус хронического паралича, вирус X пчел, вирус острого паралича.
Сыворотка № 6 (1) давала положительный результат только с эталонным штаммом Rothamstead3 BMP (титр антител 1:128). Сыворотка № 58 не реагировала с этим штаммом BMP, но реагировала с японским изолятом египетского вируса пчел (титр антител 1:64). Позднее японский изолят египетского вируса получил название ВДК пчел.
3Полный геном эталонного штамма Rothamstead (Великобритания) представлен в GenBank под номером AF092924.
При исследовании методом ПЦР личинку или куколку растирали тефлоновым пестиком в микропробирке объемом 1,5 мл. В зависимости от размера исследуемого объекта добавляли 500900 мкл физиологического раствора, интенсивно встряхивали и центрифугировали при 5000 об/мин в течение 5 мин. Аликвоту 100 мкл надосадочной жидкости использовали для выделения нуклеиновой кислоты коммерческим набором "РИБО-преп" (ФГУН ЦНИИЭ Роспотребнадзора, Москва) согласно прилагаемой инструкции. Конечный осадок растворяли в 50 мкл РНК-буфера из набора. Обратную транскрипцию проводили при 37°С 50 мин в 25 мкл с гептамерной рассеянной затравкой (100 пмоль), с 50 ед. ревертазы MMLV и прилагаемым к ней буфером 5 мкл («Promega», США, #М530) и 5 мкл РНК. По окончании пробу прогревали 3 мин при 80°С и разбавляли водой в 2 раза. В ПЦР объемом 25 мкл брали 10 мкл реакционной смеси с Taq-полимеразой (ПЦР-смесь-2-blue, ФГУ ЦНИИЭ, № 861), 200 мкмоль дНТФ и по 0,5 мкл прямого и обратного праймеров с исходной концентрацией 10 пмоль/мкл каждого; 8,5 мкл воды и 5 мкл матрицы. Амплификацию из 35 циклов проводили с температурой отжига 56°С (или 64°С в зависимости от вируса и праймеров) по программе: 1) 94° - 2 мин, 2) 94° - 10 с, 56° (64°) -15 с, 72° - 20 с, повторяли 35 раз, 3) 72° - 2 мин. По завершении ПЦР 12 мкл реакционной смеси анализировали электрофорезом в 1,8% агарозном геле в присутствии бромистого этидия в ТАЕ-буфере. Структура праймеров приведена в табл. 2.
Фрагменты, предназначенные для секвенирования, разделяли электрофорезом в 2% агарозном геле, после экстракции из геля секвенировали на автоматическом секвенаторе ABI PRISM 3100-Avant. Для нуклеотидного и филогенетического анализа использовали программы Lasergene 7 и Mega 4 и последовательности BMP, доступные в GenBank (http://www.ncbi.nlm. nih. gov).
Нуклеотидные последовательности, установленные в настоящей работе, зарегистрированы в базе данных нуклеотид-ных последовательностей GenBank под номерами JN832572-JN832575.
Результаты и обсуждение
пЦР и нуклеотидный анализ. Исследуемый материал (см. табл. 1) проверяли в ПЦР со специфическими праймерами к ВМР [9, 16], ВДК [6, 14], острого паралича [16], Кашмир [14, 15], черных маточников [14].
Во всех пробах, за исключением контрольных не-инфицированных, был обнаружен геном BMP. В двух пробах (202/8 и 203/7) выявили присутствие одновременно двух вирусов - ВМР и ВДК. Причем ВМР в этих пробах с праймерами SB1, SB2, SB3 [9] к 5'-концевой области генома удалось обнаружить, применив более чувствительный полугнездовой вариант ПЦР. Праймеры S1f и S1r [16], расположенные при-
Таблица 2
праймеры для ВМР
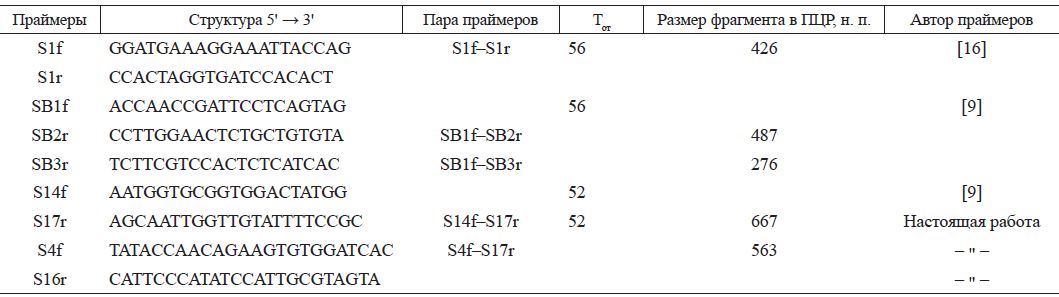
Примечание. Тот - температура отжига праймеров в ПЦР, н. п. - нуклеотидные пары.
мерно в середине 3CD гена, оказались более универсальными. С их помощью вирусный геном был обнаружен во всех образцах, за исключением пробы 203/7, что, скорее всего, обусловлено низким содержанием вируса в этой пробе, а не структурой праймеров.
Никакие другие вирусы из вышеперечисленных в исследованных пробах не обнаружили.
Для генетического исследования выбрали 3'-концевую область генома, кодирующую РНК-зависимую РНК-полимеразу, и подобрали к ней три праймера S4f, S16r, Sl7r, которые в сочетании с праймером S14f [9] позволяли применить гнездовую ПЦР в случае необходимости и могли быть использованы для секвенирования. Примечательно, что праймер S14f подошел не для всех изолятов ВМР, в то время как остальные праймеры оказались универсальными.
Фрагменты длиной 667 н. изолятов 207/4 и 212/3 были получены с праймеров S14f-S17r, а с праймеров S4f-S17r наработали фрагменты длиной 563 н. изо-лята 202/8 и двух образцов лабораторного штамма (6/ АЗ и Тг5). Образцы 6/А3 и Тг5 представляют разные пассажи одного и того же штамма № 6 и, как показало секвенирование, на исследованном участке оказались идентичными.
Филогенетический анализ и построение древа проводили по фрагменту длиной 416 н. (соответствует 8166-8582 н. по AF092924, GenBank) из области РНК-зависимой РНК-полимеразы. Выборка состояла из 42 последовательностей разного географического происхождения.
На филограмме (рис. 1) можно выделить 4 группы, или генотипа, из которых группы 1-3 были впервые описаны Е. Grabensteiner и соавт. [9]. Европейский генотип (группа 1) с эталонным штаммом из Великобритании (AF092924) объединяет вирусы Центральной Европы (Германия, Франция, Австрия, Венгрия, Испания) и Великобритании. В этой же группе вирусов оказались изоляты 207/4 и 212/3, выделенные в России (Московская обл. и Кисловодск, соответственно), гомология между которыми составляет 99%. Бли-
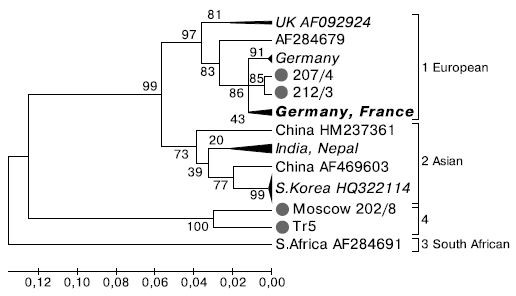
Рис. 1. Филогенетическое древо фрагмента гена РНК-зависимой РНК-полимеразы ВМР (416 н., соответствует 8166-8582 н. по AF092924) построено с помощью программы Mega 4 методом
присоединения соседей с повторной выборкой n = 1000. Исходный массив - 42 последовательности. Объединенные ветви подписаны курсивом с указанием идентификационного номера в GenBank соответствующего референтного представителя. Исследованные в настоящей работе изоляты помечены кружком.
жайшие их родственники присутствуют в Германии и Франции. К азиатскому генотипу (группа 2) принадлежат вирусы из Южной Кореи, Китая, Непала, Индии и Японии. Южноафриканский генотип (группа 3) представлен одним изолятом (AF284691) из Южной Африки.
На обособленной ветви (группа 4) расположились два других изолята из России (202/8 и Тг5), выделенные соответственно в Московской и Калужской обл. Гомология между ними составляет 94,2%, в то время как с представителями других групп она не превышает 80,6-83,5%.
Генетическое расстояние в пределах одной группы колеблется от 0,01 (группа 2) до 0,06 (группы 1 и 4), а между группами от 0,1 (группы 1 и 2) до 0,25-0,28 (группы 3 и 4). На этом основании группа 4 может быть выделена в самостоятельный генотип.
Исследуемый фрагмент гена соответствует фрагменту РНК-полимеразы, который включает функциональные домены V—VIII фермента [11, 12]. На аминокислотном уровне в функциональных доменах не обнаружено замен инвариантных (высококонсервативных) аминокислот, которые были установлены [5, 8] на основе анализа сходства РНК-зависимых РНК-полимераз ВМР с другими пикорнаподобными вирусами и пикорнавирусами (рис. 2). В то же время изоляты 202/8 и Тг5 имеют сходные с южноафриканским штаммом (AF284691) аминокислоты в позициях 2691V, 2694К, 2697I, 2724Е, а с вирусами азиатского генотипа у них совпадают аминокислоты в позициях 2749Е и 2784N. Таким образом, анализ аминокислотных последовательностей указывает на то, что изоляты 202/8 и Тг5 занимают промежуточное положение между вирусами азиатского и южноафриканского генотипов (см. рис. 1, 2).
Серологические исследования
Изоляты ВМР разных генотипов по-разному вели себя в РИД с сыворотками № 6 (1) и № 58.
Сыворотка № 6 (1) реагировала с эталонным штаммом Rothamstead ВМР (Великобритания) и изолятами обеих генетических групп, выделенных в России.
В наших экспериментах было установлено, что сыворотка № 58 содержит антитела не только к ВДК в титре 1:64, но и к ВМР генотипа 4 в титре 1:8. С ВМР европейского генотипа реакции не наблюдали ни при каком разведении, что согласуется с данными В. V. Ball4, которая установила отсутствие реакции этой сыворотки с эталонным штаммом BMP, но обнаружила в ней антитела к ВДК.
По всей видимости, материал от пчел из Таджикистана, который использовали для получения сыворотки № 58, содержал два морфологически схожих вируса - ВДК и ВМР геногруппы 4. Скорее всего, этим объясняется отрицательный результат в РИД сыворотки № 58 с эталонным штаммом BMP Rothamstead Великобритания), который принадлежит европейскому генотипу.
В РИД сыворотка № 6 (1) реагировала с обоими ге-
4Исследования проведены в Rothamsted Experimental Station, Harpenden, Hertfordshire, UK, см. Материалы и методы..
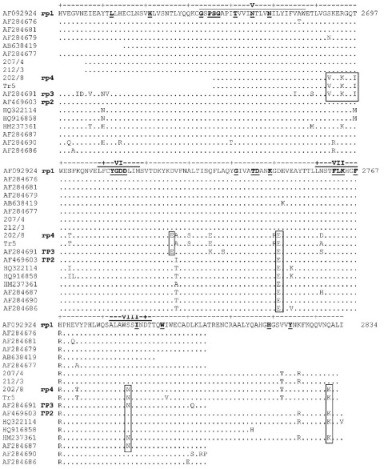
Рис. 2. РНК-зависимая РНК-полимераза ВМР (фрагмент 2627-2834, нумерация приводится справа по полипротеину AAD20260
последовательности AF092924, GenBank). Функциональные домены V-VIII (согласно [8]) обозначены над последовательностью, в них выделены жирным шрифтом и подчеркнуты консервативные аминокислоты. Слева приведены номера последовательностей из GenBank и соответствующие генетические группы. В рамку взяты аминокислоты, сходные у геногрупп 2-4.
Таблица 3
Результаты исследования патматериала в РИД и пЦР на присутствие ВМР и ВДК
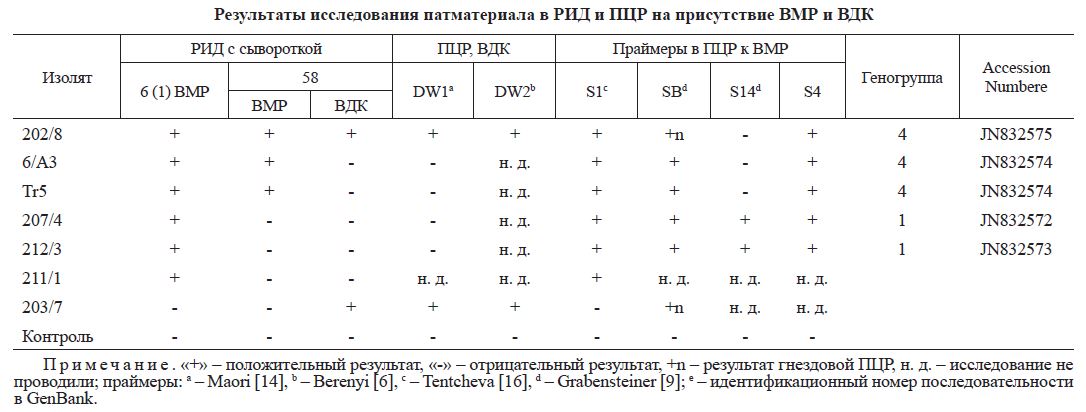
Примечание. «+» - положительный результат, «-» - отрицательный результат, +n - результат гнездовой ПЦР, н. д. - исследование не проводили; праймеры: a - Maori [14], b - Berenyi [6], c - Tentcheva [16], d - Grabensteiner [9]; e - идентификационный номер последовательности в GenBank.
нотипами BMP, однако не выявляла серологических различий между ними. В то же время при постановке перекрестной реакции сывороток № 6 (1) и № 58 с BMP генотипа 4 полосы преципитации образовывали характерную "шпору", которая свидетельствовала о более высокой специфичности сыворотки № 58 к этому генотипу.
Пробы, в которых присутствие BMP и ВДК было установлено в ПЦР, не всегда давали положительный результат в РИД (например, проба 203/7; табл. 3), что объясняется более высокой чувствительностью ПЦР по сравнению с РИД.
По результатам ПЦР и РИД изолят 202/8 содержал оба вируса - BMP и ВДК (см. табл. 3), что свидетельствует о высокой концентрации обоих вирусов в отдельно взятой особи - куколке пчелы. При этом в РИД с сывороткой № 6 (1) образовывалась одна полоса преципитации, а с сывороткой № 58 - две полосы, при этом соответствующие контрольные антигены указывали в первом случае только на реакцию с BMP, а во втором - с ВМР и ВДК одновременно. Полученные данные подтверждают наличие антител к двум вирусам BMP и ВДК в сыворотке № 58.
По-видимому, сыворотка № 6 (1) является более универсальной относительно BMP, так как распознает генотипы 1 и 4 (генотипы 2 и 3 не исследовали), а сыворотка № 58 специфична только к генотипу 4 BMP (см. табл. 3) и дополнительно содержит антитела к ВДК.
Организация генома ВМР напоминает структуру пикорнавирусов, у которых серотипическое разнообразие определяется структурой капсидных белков. Проводя аналогию с пикорнавирусами, можно предположить, что обнаруженные нами серологические отличия между двумя группами BMP, выделенными на территории России, косвенно указывают на разницу в первичной структуре капсидных белков, кодируемых 5'-проксимальной частью генома. Сек-венирование и филогенетический анализ фрагмента 3'-проксимальной части генома также выявили существенные различия между этими двумя группами. На основании проведенных исследований можно делать вывод о существовании двух генотипов ВМР у пчел А. mellifera на территории Российской Федерации. Один из них принадлежит европейской группе и циркулирует среди пчел в Краснодарском крае и Московской обл. (изоляты 212/3 и 207/4). Второй образует самостоятельную группу 4 (изоляты 202/8 и Тг5), ранее никем не описанную, которая занимает промежуточное положение между вирусами азиатского (группа 2) и южноафриканского (группа 3) генотипов. К этой группе вирусов относятся изолят 202/8, выделенный в Московской обл. в 2006 г. от пчел, завезенных из Узбекистана в 2000 г., и производные варианты (Тг5 и 6/А3) изолята № 6, выделенного в Калужской обл. в 1986 г.
Отличительными чертами этой 4-й геногруппы являются положительная реакция с сывороткой № 58 и отсутствие амплификации в ПЦР с парой праймеров S14f и S17 из-за несоответствия праймера S14f.
По результатам наших исследований, праймер S14f к области РНК-полимеразы позволил нам дифференцировать в ПЦР ВМР 1-го и 4-го генотипов.
Сравнение полноразмерных геномов изолятов из Великобритании (SBV-UK, AF092924*) и Китая (CSBV-GZ, AF469603 и CSBV-LN, НМ237361) - представителей разных геногрупп - обнаружило четыре делеции размером от 6 до 13 а. к. в полипротеиновом предшественнике, две из которых располагались в области капсидных белков [13], что свидетельствует об изменчивости и гетерогенности генома BMP и вполне допускает возможность серотипически отличных вариантов вируса.
РНК-зависимая РНК-полимераза является удобным объектом при выяснении таксономической принадлежности вирусов [5, 11, 12]. Структура этого фермента хорошо изучена для ряда РНК-^держащих вирусов. В РНК-полимеразе пикор-навирусов выделяют 8 консервативных функциональных доменов, каждый из которых имеет характерный набор (мотив) константных аминокислот. В совокупности они могут служить таксономическим маркером пикорнаподобных вирусов [5]. Именно эти мотивы и послужили в свое время ориентиром для идентификации гена РНК-полимеразы в первом отсеквенированном геноме ВМР, имею-
*Приводится название штамма и номер последовательности в GenBank.
щего сходную структуру с пикорнавирусами [8]. Детальный анализ структуры консервативных мотивов РНК-полимеразы вирусов пчел, с одной стороны, обнаружил сходство между ВМР, ВДК, вирусом Какуго и VDV (Varroa destructor virus), которые принадлежат одному роду Iflavirus, с другой стороны, четко показал отличие ВМР от остальных трех упомянутых представителей Iflavirus, с которыми у BMP гомология в области РНК-полимеразы не превышает 51-52% [5]. В этой связи результаты сек-венирования, полученные в настоящей работе, не вызывают сомнения.
Итак, в европейской части России среди пчел A. mellifera циркулируют 2 генотипа ВМР. Аналогичную ситуацию, когда на одной территории присутствуют 2 генотипа BMP, наблюдали в Японии [10] и Непале [9]. Но там для каждого генотипа BMP прослеживалась специфичность относительно видовой принадлежности хозяина: европейский генотип BMP был распространен исключительно среди интродуцирован-ного вида европейской пчелы А. mellifera, а азиатский - среди азиатской пчелы А. сеrаnа [7, 10]. В нашем случае у одного и того же вида хозяина A. mellifera встречается европейский генотип BMP - что вполне закономерно - и филогенетически отдаленный неизвестный генотип.
Остается только предполагать, каким образом в центральной части России оказались BMP неизвестного доныне генотипа (геногруппа 4). Чтобы разобраться в этом вопросе, нужно проследить историю пчел-хозяев этих вирусов. Пчелы, от которых был выделен изолят 202/8, были завезены в Москву из Узбекистана в 2000 г. В свою очередь, сыворотка № 58, которая положительно реагирует с изолятом 202/8, была получена к вирусам, циркулировавшим в Таджикистане в 1980-x годах. Таким образом, изначальным ареалом 4-го генотипа BMP могла быть Средняя Азия, где во времена СССР располагался ряд пчелопитомников, из которых пчел завозили во многие регионы страны. В этом контексте становится объяснимым присутствие BMP 4-го генотипа в европейской части России.
Ломакина Наталья Федоровна - канд. биол. наук, вед. науч. сотр., e-mail:Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.;
Батуев Юрий Михайлович — канд. биол. наук, вед. науч. сотр.
ГНУ Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. Я. Р. Коваленко, РАСХН, Москва